MATERIAL :
- Microscopio.
- Una cámara de recuento de Neubauer mejorado.
PROCEDIMIENTO :
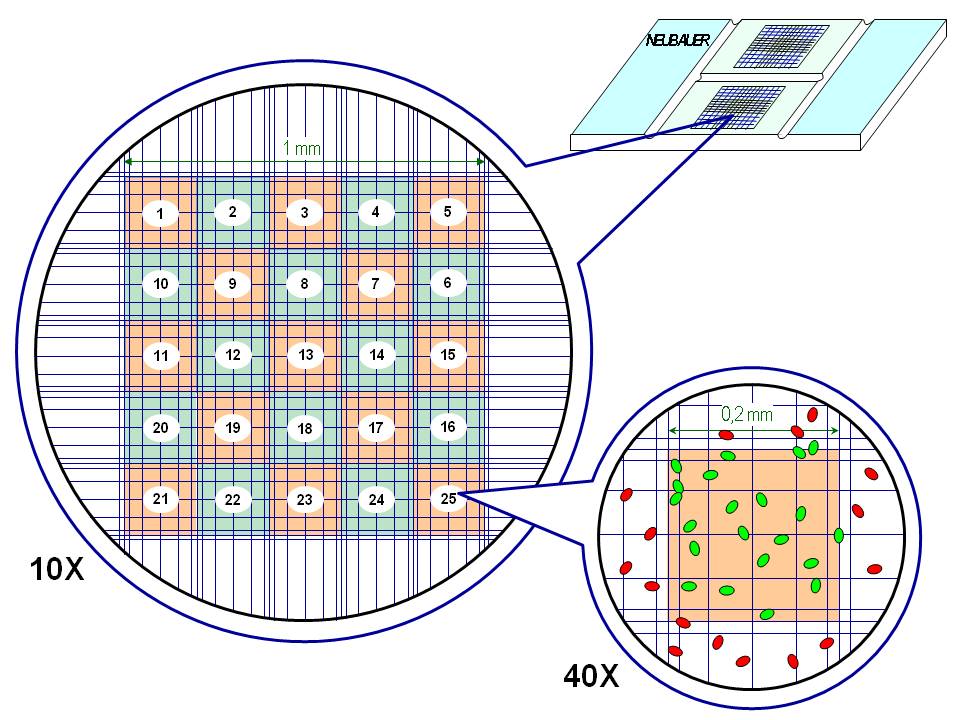
1º Observar con el microscopio el reticulo de la cámara de recuento:
- Primero,con el objetivo de pequeño aumento (4x).
- Después ,con el objetivo de mediano aumento (10x).
- Y por último,con el objetivo de gran aumento 40x ).
2ºEnfocar ,con el objetivo de 10x,uno de los cuadrados grandes situados en las cuatro esquinas del reticulo .
Contar el número de cuadros medianos contenidos en ese cuadro grande periférico :16.
Teniendo en cuenta que la longitud de de cada uno de los lados delreticuloes de 3 mm,calcular :
- La longitud de los lados de cada cuadro grande periférico : 1 mm.
- La longitud de los lados de cada uno delos cuadros medianos englobados en un cuadro grande periférico : 0,25
Teniendo en cuenta que la longitud del espacio comprendido entre el reticulo y el cubre es de 0,1 mm,calcular el volumen de sangre diluida que hay en la cámara de recuento montada,a nivel de :
- El retículo entero : 3 x 3 x 0,1=0,9 mm3
- Un cuadro grande periférico :1 x 1 x 0,1= =01mm3
- Un cuadrado mediano incluido en un cuadro grande periférico : 0,25 x 0,25 x 0,1 = 6,25 x 10 -3
3º Enfocar ,con el objetivo de 10x,el cuadro grande central .
Contar el número de cuadros medianos contenidos en ese cuadro grande central : 5 x 5= 25 cuadros.
Contar el número de cuadros pequeños englobados en uno de esos cuadros medianos : 16 medianos.
Teniendo en cuenta que la longitud de cada uno de los lados del retículo es de 3 mm,calcular :
- La longitud de los lados del cuadro grande central :1 mm
- La longitud de los lados de cada uno de los cuadros pequeños incluidos en el cuadro grande central : 1 : 5 = 0,2mm
- La longitud de los lados de cada uno de los cuadros pequeños contenidos en uno de eso cuadros medianos : 0,2 : 4 = =0,05
- Teniendo en cuenta que la longitud del espacio comprendido entre el reticulo y el cubre es de o,1 mm, calcular el volumen de la sangre diluida que hay en la cámara de recuento montada,a nivel de :
- El cuadrado grande central : 1 mm x 1mm x o,1 = 0,1 mm3
- Un cuadro mediano englobado en el cuadro grande central : 0,2mm x 0,2 mm x 0,1 =0,004 mm3
- Un cuadro pequeño incluido en uno de esos cuadros medianos :
0,05 x 0,05 x 0,1 = 2,5 x 10 -4 mm3